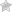На искусственных питательных средах можно выращивать
Риск на грани. Как открыли хеликобактер пилори?

В сказках бывают заколдованные предметы. Человек ходит вокруг них, но не может обнаружить. История открытия бактерии хеликобактер пилори напоминает такую сказку. В ней нет волшебства. Чтобы добраться до истины, потребовались разум, самоотверженность и упорство. И от этого история становится особенно захватывающей.
Таинственная спираль
Долгое время считалось, что среда желудка стерильна. Ведь в состав желудочного сока входит соляная кислота. Возможность существования бактерий в такой среде вызывала серьёзные сомнения. Поэтому изучению желудочной микрофлоры уделяли мало внимания.
Однако во все времена для учёных не существует мелочей. Несколько раз люди вплотную подходили к открытию бактерии. Более чем за век до Маршалла и Уоррена немецкие физиологи обнаружили неведомый ранее микроорганизм в слизистой оболочке желудка собак и человека. Что помешало открытию? Учёные так и не смогли вырастить колонию, пригодную для изучения. Микроорганизм не размножался на известных в тот момент питательных средах.
В 1886 году Валерий Яворский – профессор Ягеллонского университета в Кракове – обнаружил спиралевидную бактерию в промывных водах человеческого желудка. Профессор назвал её Vibrio rugula, составил подробное описание и даже выдвинул гипотезу о её влиянии на развитие желудочных заболеваний. Публикация вышла в свет в 1889 году. Однако в научных кругах версию Яворского оставили без внимания. Во-первых, за пределами Польши мало кто интересовался изданиями на польском языке. Во-вторых, сказалось убеждение: кислая среда стерильна.
В 1893 году подобное описание составил итальянский врач Джулио Бидзодзеро. Его работа также осталась без внимания.
В 1913 году датский микробиолог Йоханнес Фибигер обнаружил, что у крыс и мышей, употреблявших заражённую бактериями пищу, может развиваться рак желудка. Это поколебало общее представление о незначительной роли бактерий в появлении патологий желудка. В 1926 году Фибигер получил Нобелевскую премию. Но кислотно-пептическая теория патогенеза язвенной болезни оставалась приоритетной.
До 70-х годов ХХ века появлялись и другие исследования, авторы которых вплотную подошли к открытию хеликобактер пилори. Многим не хватило одного шага.
Терпение, труд и один счастливый случай
Во второй половине ХХ века арсенал диагностических методов существенно вырос. В частности, появились эндоскопические исследования, позволяющие взять фрагмент слизистой для исследования (биопсия). Ткани для исследования почти всегда брали у пациентов с язвенной болезнью и опухолями желудка, а иногда и при тяжёлых гастритах. Австралийский учёный Робин Уоррен обнаружил, что у большинства пациентов в биоптате (кусочек полученной при биопсии ткани для анализа) присутствует спиралевидная бактерия. Уоррен собрал большой материал, классифицировал образцы биоптата по патоморфологическим характеристикам, но работе не хватало клинического осмысления. Требовалось дальнейшее изучение.
В этот период на работу в Королевский госпиталь города Перта устроился молодой учёный Барри Маршалл. Он мечтал стать кардиологом, но в 1981 году обстоятельства привели его в отделение гастроэнтерологии. Там и состоялось знакомство Робина Уоррена и Барри Маршалла. Уоррен оценил юного коллегу: тот был открыт новому, в то время как большинство врачей продолжало пренебрежительно относиться к роли желудочной микрофлоры. Вскоре Маршалл включился в работу. Учёные впервые смогли вырастить недооткрытый предшественниками микроорганизм на искусственных питательных средах. Помог случай. Результата обычно ждали по 48 часов. Но одну чашку Петри с культурой перед пасхальными каникулами забыли в инкубаторе. Рост бактерий обнаружился через 5 дней. Загадочной спирали просто требовалось больше времени.
Сперва бактерию назвали Campylobacter pylori, но в 1989 году анализ ДНК показал, что она не принадлежит к роду Campylobacter. Обитающая в желудке бактерия получила новое имя – Helicobacter pylori (хеликобактер пилори).
Требовалось экспериментальное подтверждение её влияния на возникновение гастрита и язвенной болезни. Медицинское сообщество считало теорию далёкой от истины, первые опыты на животных не дали убедительного результата, согласовать исследование с участием людей было трудно. Барри Маршалл решил поставить эксперимент на себе.
Жертвенник науки
В 1984 году Барри Маршалл добровольно выпил жидкость, содержащую бактериальную культуру. Вскоре после этого у учёного развился гастрит. Эндоскопическое исследование подтвердило наличие хеликобактер пилори. Маршалл ожидал такого результата, но впоследствии признался, что был застигнут врасплох тяжестью инфекции. Следующим этапом эксперимента стал двухнедельный курс лечения метронидазолом и солями висмута. После антибактериальной терапии симптомы заболевания исчезли, а эндоскопия показала отсутствие бактерий в желудке.
Отчаянный шаг Барри Маршалла привлёк внимание учёных всего мира. Медицинский исследовательский совет Австралии согласился финансировать дальнейшую работу. В Великобритании исследование повторил Мартин Скирроу. Вскоре выяснилось, что во многих случаях хеликобактер пилори является причиной гастрита, дуоденита, язв желудка и двенадцатиперстной кишки, некоторых видов опухолей желудка (в том числе рака). Подтвердилась эффективность антибиотиков в лечении вызванных бактерией гастрита и язвы.
В 2005 году Робин Уоррен и Барри Маршалл были удостоены Нобелевской премии по физиологии и медицине.
Новости

Cельское хозяйство перемещается в небоскребы
Мир будущего — это мир больших городов. Рост населения планеты заставляет все больше беспокоиться о нехватке плодородных земель, урбанизация и глобализация — о продовольственном самообеспечении мегаполисов. Решить эти проблемы поможет сельское хозяйство нового типа: выращивание растений без почвы в локальных многоэтажных агрокомплексах и роботизированных теплицах. Авторы очередного выпуска трендлеттера «Глобальные технологические тренды» ИСИЭЗ НИУ ВШЭ выделяют три ключевых тренда в развитии сельского хозяйства и дают по ним прогнозные оценки.
Выращивание растений в искусственных питательных средах до 5 раз повысит урожайность в расчете на один гектар
1–2 трлн долларов к 2040 г. могут составить суммарные мировые инвестиции в вертикальные фермы
Использование роботов в тепличном хозяйстве России может повысить производительность труда на 50–60% к 2040 г.
Эксперты Высшей школы экономики называют одним из наиболее перспективных направлений исследований и разработок в сфере сельского хозяйства внегрунтовое выращивание растений. По их мнению, технологии внегрунтового растениеводства, которые включают гидропонику, аквапонику и аэропонику, минимизируют две важнейшие проблемы сельского хозяйства: деградацию почв в результате их сельскохозяйственного использования и зависимость урожаев от природных катаклизмов, прежде всего засух.
Комментирует ведущий эксперт Форсайт-центра Института статистических исследований и экономики знаний НИУ ВШЭ Илья Кузьминов:
Человечество на сегодняшней беспрецедентно высокой ступени технологического и организационного развития не может себе позволить зависимость политико-экономических процессов от таких непредсказуемых факторов, как погодные условия. Политические перевороты в результате неурожаев зерновых — явно не должны быть атрибутом XXI века. Сбои в цепочках снабжения продовольствием крупных мегаполисов чреваты не только рисками человеческих жертв в этих конкретных городах, но и рисками нарушения процессов управления глобальными системами, поскольку рычаги управления мировой экономикой все больше сосредотачиваются в глобальных городах.
Пока человечеству хватает сельскохозяйственных угодий, число голодающих в мире реально сокращается. Однако на сверхдолгосрочном горизонте (50-100 лет) связанные с традиционным сельским хозяйством проблемы, вероятнее всего, обострятся. Десять миллиардов человек еще до 2050 г. — вполне реальный сценарий. Их надо как-то прокормить и при этом не допустить сведения лесов под сельхозугодья, деградации почв, снижения биоразнообразия. Все это подводит к необходимости превращения сельского хозяйства в отрасль наподобие металлургической, химической или машиностроительной промышленности, когда производство концентрировано, локально, автоматизировано, и происходит в специализированных зданиях заводского типа с контролируемой средой.
О том, какие рынки в связи с этим открываются, а также подробнее о других трендах читайте в новом выпуске трендлеттера, с которым можно ознакомиться по ссылке. Скачать версию для печати.
См. публикации в СМИ:
Предыдущие выпуски:
№ 8(14): Энергетический разворот к Cолнцу
№ 7 (13): «Умная» инфраструктура для внегородских магистралей
№ 6 (12): Ферменты на службе у медицины: применение для молекулярной диагностики и генной инженерии
№ 5 (11): Здравоохранение становится все более ИКТ-зависимым
№ 4 (10): Новые технологии для лесного сектора
№ 3 (9): Наукоемкие материалы для новой электроники и энергетики
№ 2 (8): Медицина будущего: технологии генетической инженерии для создания высокоспецифичных лекарств и инструментов молекулярной диагностики
№ 1 (7): Эффективные технологии для тепловой энергетики
№ 6: К 2030 году самолеты станут более экологичными
№ 5: Круговорот возобновляемого сырья: биодизель из микроводорослей, биоразлагаемая полимерная упаковка, электроэнергия из органических отходов
№ 4: «Умные» энергосети повысят эффективность российской энергосистемы
№ 3: Каршеринг с децентрализованной инфраструктурой и беспилотные автомобили помогут победить пробки
№ 2: Россия в Арктике: прочные морские платформы, новые ледоколы и извлечение метана из газогидратов
№ 1: Аптамеры РНК, микрочипы под кожу и карманные биосенсоры
К вопросу о культивировании spir. pallida на жидких питательных средах

- Авторы:Аристовский В.М. 1 , Гельтцер Р.Р. 1
- Учреждения:
- Бактериологический Институт Казанского Университета
- Выпуск: Том 22, № 1 (1926)
- Страницы: 19-22
- Тип: Статьи
- URL:https://kazanmedjournal.ru/kazanmedj/article/view/50315
- Цитировать
Полный текст
- Аннотация
- Полный текст
- Об авторах
- Список литературы
- Дополнительные файлы
- Статистика
Аннотация
За последние годы в вопросе о культивировании спирохэт вообще сделаны большие успехи, и, если для целого ряда патогенных и непатогенных спирохэт разработаны сравнительно-несложные и вполне надежные методы выращивания их in vitro как на твердых, так и на жидких питательных средах, то в вопросе о культивировании бледной спирохэты мы идем вперед очень медленно, и успехи, достигнутые за последнее время в этой области, нужно признать очень скромными.
Ключевые слова
Полный текст
За последние годы в вопросе о культивировании спирохэт вообще сделаны большие успехи, и, если для целого ряда патогенных и непатогенных спирохэт разработаны сравнительно-несложные и вполне надежные методы выращивания их in vitro как на твердых, так и на жидких питательных средах, то в вопросе о культивировании бледной спирохэты мы идем вперед очень медленно, и успехи, достигнутые за последнее время в этой области, нужно признать очень скромными.
Главные работы Scheresсhеwsk’ого, Mühlens’а, Nogouchi, Hoffmann’а, разрешили с принципиальной точки зрения и в положительном смысле вопрос о возможности культивирования spir. pallida на искусственных питательных средах. Последующие работы Schmamine, Nakano, Tomaschewsk’ого, Baeslack’а, Arnheim’а, Sowade и др. касаются, главным образом, методов культивирования на твердых и полутвердых питательных средах и по преимуществу в условиях смешанной культуры; получение же чистой культуры, даже при этих условиях, является случайной редкостью и требует огромной затраты времени и труда.
В виду того, что твердые и полутвердые питательные среды представляют целый ряд неудобств для наблюдения и экспериментирования, естественно явилось стремление к разработке методов культивирования бледной спирохэты на жидких питательных средах, и в последнее время этот вопрос привлек к себе внимание целого ряда исследователей. Первыми, кому удалось получить чистую культуру sp. pallida на жидкой среде, был Nogouchi (Serumwasser+кусочек свежего яичка или почки кролика). Но насколько среда Nogouchi далека от идеала, можно судить по тому, что такому исследователю, как Mühlens, ни разу не удалось получить чистой культуры бледной спирохэты на этой среде. Попытки Uhlenhuth’а, Ungermann’а, Habermann’а получить чистую культуру на жидких средах кончились неудачей. Удачными за последнее время были в этом отношении опыты Wassermann’а и Ficker’а, которые сообщают о получении ими чистых культур как на жидких, так и на твердых питательных средах; к сожалению, авторы не сообщают состава своих питательных сред. Об удачных опытах сообщают также Saureguі и Lance1otti. Что касается исследований Krantz’а, произведенных в 1923—24 году, то, повидимому, здесь дело идет о смешанных культурах. Попытки же Grütz’а перевести полученные им на полусвернутой человеческой сыворотке 2 штамма бледной спирохэты на жидкие среды окончились неудачей.
Такое положение дела и побуждает нас сообщить результаты наших опытов получить чистую культуру spir. pallida на жидкой среде. Многочисленные попытки наши получить такую культуру, пользуясь исходным материалом, содержащим спирохэт в чистом виде (яичко кролика при орхите, сок из лимфатической сифилитической железы человека), кончились неудачей, несмотря на то, что для опытов своих мы пробовали применять все наиболее известные из предложенных жидких питательных сред. За последнее время мы взяли в качестве исходного материала смешанную культуру бледной спирохэты, которая у нас втечение уже 2 лет поддерживается в лаборатории на среде Schereschewsk’ого и которая была получена при посеве на эту среду кусочка сифилитической папулы человека. Наблюдая от генерации к генерации за соотношением между количеством сопровождающих бактерий и спирохэт, мы подметили, как это соотношение постепенно меняется в пользу последних. Выбирая для посевов культуры наиболее богатые спирохэтами и бедные посторонними бактериями, мы достигли того, что в некоторых участках среды спирохэты развивались в чистой культуре. Однако пересевы из таких участков снова на среду Schereschewsk’ого с целью получения на этой среде чистой культуры заканчивались неудачей: спирохэты в чистом виде не росли на среде Schereschews’ого. Точно также кончились неудачей пересевы со среды Schereschewsk’ого на жидкие среды, предложенные другими авторами.
Тогда мы сделали попытку приготовить свои среды. Первые ободряющие результаты мы получили при применении кроличьей инактивированной сыворотки (1 час при 60°) с прибавлением свежего кусочка яичка или мозговой ткани кролика. В дальнейшем при замене в этих средах кроличьей сыворотки сывороткой лошади мы получили отрицательные результаты. Наоборот, замена кроличьей сыворотки некоторыми сортами асцита привела к получению очень богатых культур.
Так как наши наблюдения над средами с асцитом показали, что успех зависит от каких-то ближе нам неизвестных свойств асцитической жидкости (количество белка? примесь желчи?), а в то же время с несомненностью указывали на преимущество удачно подобранной асцитической жидкости перед кроличьей сывороткой, то мы применили для изготовления наших питательных сред человеческую инактивированную сыворотку. Наблюдения наши показали, что такая сыворотка вполне может заменить хорошую асцитическую жидкость. Мало того, — оказалось, что особенно пригодной является человеческая сыворотка, полученная из плацентарного конца пуповины.
В конечном итоге мы в настоящее время остановились на следующей методике изготовления жидкой среды: гретая сыворотка человеческой крови, полученной из плацентарного конца пуповины, разводится физиологическим раствором NaCl в отношении 1:2; на дно проборки опускается кусочек свежей мозговой ткани или свежего яичка кролика; т. к. технически легче получить стерильно и в большем количестве мозг кролика, чем яичко, то мы готовим среды по преимуществу с кусочками мозговой ткани. После засева пробирка с жидкой средой заливается расплавленным. вазелином. Выращивание производится при 35° С. Maximum развития культуры достигается при этом в различные сроки — от 3—4 до 7—8 дней. На этой среде мы имеем чистую культуру бледной спирохэты, проделавшую на ней к настоящему времени свыше 75 генераций.
Наши наблюдения показывают, что культивирование бледной спирохэты на жидкой среде в чистом виде до настоящего времени остается делом очень трудным и кропотливым, и, если нам удалось в результате проделанной большой работы добиться получения чистой культуры на нашей питательной среде, то мы, конечно, далеки от мысли считать метод, которым мы пришли к получению чистой культуры, вполне удовлетворительным. Трудности, которые стоят на пути выработки простого и надежного метода, относятся к двум моментам. Прежде всего это — получение первой генерации спирохэт от больного человека или животного. Нужно сказать, что эта задача сравнительно нетрудно решается в случае, если дело идет о получении смешанной культуры на среде Schereschewsk’ого. Сопровождающие микроорганизмы несомненно при этом имеют благоприятное влияние на условия роста спирохэт, и, вероятно, роль этих микроорганизмов сводится к расщеплению питательного субстрата среды, неспособного непосредственно служить для питания спирохэт и к накоплению в среде продуктов ферментативного распада белковых тел, легко усвояемых спирохэтами и т. о. обеспечивающих их существование. В условиях такого сожительства спирохэты в ряде генераций успевают постепенно приспособиться к жизни на искусственных питательных средах, приобретают способность разлагать более сложные питательные вещества и т. о., в конце концов, обходиться без помощи сопровождающих микроорганизмов. Вот тогда-то и наступает удобный момент для выделения спирохэт в чистой культуре, что мы наблюдаем и в нашем случае. Насколько spir. pallida может стать нетребовательной к питательному субстрату, показывают наблюдения Krantz’а, который выращивал спирохэт в 0,5% растворе мочевины.
Другим трудным моментом является выделение спирохэт в чистом виде из смешанной культуры. До сего времени здесь нет простого и надежного метода, и дело продолжает носить случайный характер. Казалось-бы, что выход из положения можно найти в применении в качестве исходного материала для посевов тех патологических продуктов, где бледная спирохэта находится уже в чистом виде. Наши наблюдения, однако, убедили нас, что спирохэты такого происхождения являются чрезвычайно требовательными к условиям выращивания их in vitro, и те питательные среды, на которых обильно размножаются спирохэты в смешанной культуре, или спирохэты, успевшие приспособиться к жизни in vitro, являются непригодными для развития в чистом виде спирохэт, непосредственно происходящих от больного организма. Но разработка именно такого прямого метода нам кажется в дальнейшем наиболее желательной, т. к. при этих условиях обеспечивается больше всего получение культуры сифилитических спирохэт с теми свойствами и особенностями, которые присущи этим спирохэтам, когда они находятся в тканях больного организма. Наоборот, при получении чистой культуры спирохэт из смешанной больше всего грозит опасность, что выделенная в конце концов чистая культура, проделавшая предварительно ряд мытарств на искусственных питательных средах, окажется лишенной многих из тех свойств, которые ей присущи в организме больного, и которые для нас особенно ценны.

Рис. 1. 4-дневная культура spir. pallida в жидкой среде. Dunkelfeldbeleuchtung. Ок. Leitz’a № 4, об. Leitz’a № 6a.
Abb. № 1. 4-tagige Kultur der sp. pallida in fluss. Nährboden. Dunkelfeldbeleuchtung. Okul. Leitz № 4, Ob. Leitz № 6a.

Рис. 2. Та же культура. Мазок, фиксир. метил. алкоголем, окраш. по. Giemsa. Ок. comp. Zeiss’a № 6, об. Zeiss’a 2 mm.
Abb. № 2. Dieselbe Kultur. Ausstrichpräparat, Fixierung mit Methylalcohol, Färbung nach Giemsa. Okul. comp. Zeiss № 6, Ob. Zeiss 2 mm.
Prof. W. M. Arijstowsky und I)-r R. R. Hoeltzer (Kasan). Heber die Kultivierung der spiroch. pallida in flüssigen Nährböden.
Nach vielen misslungenen Versuchen die Kultur der spiroch. pallida auf bekannten flüssigen Nährböden aus einer Mischkultur nach Scheresellewsky zu bekommen, gelang es den Autoren eine Reinkultur auf dem flüssigen, von ihnen zusammengesetzten Nährboden zu erhalten. Dieser Nährboden besteht aus inaktivierten Menschensernm, am besten vom Blute aus der Placentarende des Nabelschnurs gewonnen, mit 2 Teile physiologischer Kochsalzlösung verdünnt und mit Zusatz eines Stückchens frischen Gehirngewebe oder Hoden vom Kaninchen. Die beimpften Röhrchen werden mit geschmolzenen Vaselin überschichtet. Züchtung bei 35° C. Maximum der Entwieckelung am 3—5 oder 7—8 Tage. Auf diesen Nährboden hat der Stamm der spiroch. pallida in Reinkultur zur Zeit mehr als 75 Generationen durchgemacht.
На искусственных питательных средах можно выращивать

Микробиологическое исследование — это выделение чистых культур микроорганизмов, культивирование и изучение их свойств. Чистыми называются культуры, состоящие из микроорганизмов одного вида. Они нужны при диагностике инфекционных болезней, для определения видовой и типовой принадлежности микробов, в исследовательской работе, для получения продуктов жизнедеятельности микробов (токсинов, антибиотиков, вакцин и т. п.).
Для культивирования микроорганизмов (выращивание в искусственных условиях in vitro) необходимы особые субстраты — питательные среды. И спользуются различные по составу питательные среды, в которых должны содержаться все вещества, необходимые для роста. Потребности микроорганизмов в питательных веществах чрезвычайно разнообразны и определяются особенностями их метаболизма. Поэтому универсальных сред, одинаково пригодных для роста всех микроорганизмов, не существует.
В широком смысле слова питательнаясреда должна соответствовать следующим требованиям — включать доступный для клетки источник энергии.Для одних организмов (фототрофов) таким источником служит свет, для других — органический (хемоорганотрофы) или неорганический (хемолитотрофы) субстрат.
Также содержать все необходимые компоненты для реализации конструктивных процессов в клетке. Причем синтетические способности микроорганизмов могут варьировать от использования углекислого газа в качестве единственного источника углерода (автотрофы) до потребности в более восстановленных соединениях углерода — кислотах, спиртах, углеводах и др. (гетеротрофы).
В узком смысле слова любая искусственная питательная среда должна соответствовать следующим требованиям: содержать все необходимые для роста питательные вещества в легко усвояемой форме; иметь оптимальную влажность, оптимальную вязкость, оптимальную рН, (оптимальные — для конкретного микроорганизма), быть изотоничной, сбалансированной с высокой буферной емкостью и, по возможности, прозрачной.
Питательной средой в микробиологии называют среды, содержащие различные соединения сложного или простого состава, которые применяются для размножения микроорганизмов, их культивирования и сохранения в лабораторных или промышленных условиях.
Выбор состава питательной среды зависит в значительной степени от целей эксперимента либо промышленного процесса.
П итательные среды делятся на натуральные, синтетические и полусинтетические. Также они могут классифицироваться как среды определенного и неопределенного состава.
Натуральными называют среды, которые состоят из продуктов растительного или животного происхождения, имеющих неопределенный химический состав . Примерами питательных сред такого типа являются среды, представляющие собой смесь продуктов распада белков (казеина, мышц млекопитающих), образующихся при их гидролизе. К питательным средам неопределенного состава можно отнести и среды, полученные на основе растительного сырья: картофельный агар, томатный агар, отвары злаков, дрожжей, пивное сусло, настои сена и соломы и др. Основное назначение таких питательных сред — выделение, культивирование, получение биомассы и поддержание культур микроорганизмов.
К числу сред неопределенного состава относят и среды полусинтетические . В такую среду вносят известные соединения как явно необходимые; а также добавляют небольшое количество дрожжевого или кукурузного экстракта (или любого другого природного продукта) для обеспечения неизвестных потребностей роста. Такие среды часто используются в случае промышленного культивирования биологических объектов для получения продуктов метаболизма, например, для получения аминокислот, антибиотиков, витаминов и т.д.
Синтетические среды — это среды определенного состава , представленные чистыми химическими соединениями, взятыми в точно указанных концентрациях и соотношениях отдельных элементов. Обязательными компонентами таких сред являются неорганические соединения (соли) и углерод- и азотсодержащие вещества (типичными представителями являются глюкоза и (NH4)2SO4. Часто к таким средам добавляют буферные растворы и хелатирующие соединения. Основное назначение таких питательных сред — изучение особенностей физиологии и метаболизма микроорганизмов, выделение генетических рекомбинантов и т.д.
По назначению среды разделяют на основные , элективные (селективные) и дифференциально-диагностические . К основным относятся среды, применяемые для выращивания многих бактерий. Это питательный бульон и питательный агар. Такие среды служат основой для приготовления более сложных питательных сред. Элективные среды обеспечивают преимущественное развитие одного или целой физиологической группы микроорганизмов. Например, для выделения стафилоккоков в среду может быть добавлен хлористый натрий в концентрации 7,5%. При этой концентрации рост других бактерий подавляется. Элективные среды применяются на первом этапе выделения чистой культуры бактерий, т.е. при получении накопительной культуры.
По консистенции среды могут быть жидкими, полужидкими, твердыми, сыпучими
Жидкие питательные среды (Мясопептон-бульон, п ептонная вода) получают при растворении в воде определенного необходимого набора питательных веществ, макро- и микроэлементов. По составу они могут быть как натуральными, так и синтетическими.
Среды в твердом состоянии (мясопептон-желатина, мясопептон-агар, кровяная сыворотка и др.) в форме плотных гелей используются в бактериологии со времен Р. Коха. Наиболее важным преимуществом использования твердых сред является то, что на них можно выращивать микроорганизмы в виде колоний, образующихся из отдельных клеток популяции. Приготовление твердых питательных сред достигается добавлением к жидким средам определенных уплотнителей, в качестве которых могут выступать агар, желатина, силикагель, каррагенан.
Полужидкие средысодержат гелеобразующее вещество в низкой (0,3 — 0,7%) концентрации и имеют мягкую желеподобную консистенцию. Такие среды пригодны для изучения подвижности и хемотаксиса клеток, культивирования микроаэрофилов.
Сыпучие среды представляют собой массу в той или иной степени измельченного и увлажненного сырья (обычно, растительного). Основное их назначение — использование в пищевой промышленности (получение соевого соуса или рисовой водки), сельском хозяйстве (силосование кормов) и т.д.
В бактериологической практике чаще всего используются сухие питательные среды, которые получают в промышленных масштабах — триптические гидролизаты дешевых непищевых продуктов (рыбные отходы, мясокостная мука, технический казеин) с добавлением агара. Сухие среды являются достаточно дешевым сырьем, могут храниться в течение длительного времени, удобны при транспортировке, имеют относительно стандартный состав, на их основе быстро и легко готовить питательные среды.
Научная электронная библиотека

Сибагатуллина А. М., Мазуркин П. М.,
2.4. Технология выращивания культуры водоросли
На практике наиболее распространенными методами биотестирования являются такие, в которых фиксируются, главным образом, такие интегральные параметры, как показатели выживаемости, роста, плодовитости тест-организмов.
Все методы биотестирования характеризуются своими особенностями. Это и доступность тест-объекта, которая определяется возможностью их культивирования в лабораторных условиях, поддержанием необходимых условий температуры, освещенности, сложностью состава питательных сред, чистотой воздуха и пр. Это и оперативность получения ответа.
Наиболее быстрые реакции на токсическое воздействие равных концентраций удается регистрировать у простых организмов – бактерий, водорослей и инфузорий. Наступление таких реакций ограничивается минутами или несколькими часами. Сутками измеряется проявление ответных реакций более крупных объектов (у ракообразных – дафний), а так называемая хроническая токсичность оценивается в течение многих суток и даже недель. Каждый метод характеризуется и своими техническими способами реализации. Общим правилом для всех методик является оценка надежности тест-культур.
В качестве тест – организма в наших экспериментах была использована одноклеточная зеленая водоросль Chlorella vulgaris. Данная водоросль легко культивируется (выращивается) на искусственных питательных средах и быстро размножается. Кроме этого, она широко распространена в природе и хорошо изучена учеными. В качестве питательной среды взята минеральная среда Тамия следующего состава (г/л): КNО3 – 5.0; MgSO4+7H2O – 2,5; KHPO4 – 1,25. Питательная среда и растворы солей готовятся на дистиллированной воде и не подвергаются стерилизации. Для избегания образования осадка, навеску каждого вещества сначала растворяют в небольшом количестве воды, а затем растворы сливают вместе в указанной выше последовательности и доливают воду до соответствующего объема. Перед внесением водорослей питательная среда (100%) разбавляется в 2 раза дистиллированной водой (50%).
 .
.
Рис.2.2. Культиватор КВ-05
Наращивание исходной культуры водоросли производится в специальном культиваторе КВ-05, рис.2.2. В качестве реактора используется прозрачная бутыль из бесцветного стекла емкостью 400 мл. В реактор заливается суспензия водоросли в объеме 150мл. Для обеспечения углекислым газом, за счет растворения содержащегося в воздухе CO2 и перемешивания суспензии непрерывно вращается вокруг своей продольной оси. В процессе культивирования суспензия водоросли облучается светом лампы накаливания 40 Вт, 220В, установленный над реактором. Постоянная температура поддерживается автоматическим включением и выключением встроенного вентилятора по команде блока термостабилизации прибора.
Засев водоросли производится с начальной оптической плотностью 0,020±0,005. Для этого в 150 мл 50% питательной среды (среда Тамия, разбавленная дистиллированной водой в 2 раза) вносится 15 мл суспензии водоросли, профильтрованной через 3-4 слоя марли с оптической плотностью 0,220. Культура выращивается в полустационарном режиме, который достигается ежедневным пересевом в свежую среду. Такой режим культивирования позволяет без соблюдения условий стерильности поддерживать чистую культуру водоросли. При перерывах в работе свежевыращенную культуры водоросли можно хранить в холодильнике при температуре 2-4 °С в течение 2-4 месяцев. При возобновлении работ по биотестированию хранящуюся культуру водоросли следует активировать, прокультивировав одни сутки в культиваторе «КВ-05», как указано выше.
В качестве показателя светопропускания в приборе ИПТ-02, рис.2.3 используется величина оптической плотности, регистрируемая в круглой кювете («пенициллиновом» флаконе) на красном свету (длина волны 660 нм), который близок по спектру длинноволновому максимуму поглощения хлорофилла. Для уменьшения влияния оптической неоднородности стенок флакона на результаты измерения измерительный свет просвечивает кювету в трех направлениях.
 .
.
Рис.2.3. Измеритель плотности ИПТ-02
Согласно основному закону светопоглощения, между величиной оптической плотности (D) и концентрацией растворенного вещества в измеряемом растворе существует прямопропорциональная зависимость. Аналогичная связь имеет место между D и количеством клеток в суспензии водоросли. Таким образом, через величину оптической плотности можно оперативно и достаточно точно определить насколько изменилась численность клеток в процессе роста культуры водоросли. Если не требуется высокая точность измерений, допустимо проводить измерение оптической плотности непосредственно во флаконах, в которых выращивались тест-культура. В этом случае после настройки прибора «ИПТ-02» по эталонной кювете с дистиллированной водой все флаконы культиватора «Фитотестер 03» последовательно помещаются в кюветный узел прибора.
Измерение температуры, которое также позволяет делать прибор «ИПТ-02» после его переключения в соответствующий режим работы (Т°), производится выносным датчиком. Чтобы обеспечить более точный и быстрый замер Т° необходимо делать несколько помешивающих движений термодатчиком в измеряемой среде. Для стабилизации температурного режима прибор должен быть включен за 15 минут до начала работы.
С целью изучения зависимости наиболее обобщенного показателя жизнедеятельности культуры водоросли – скорости ее роста – от факторов внешней среды, в том числе и тех, которые оказывают на нее токсическое воздействие, используется многореакторный культиватор «Фитотестер-03», рис.2.4. Данный культиватор представляет собой плоский прямоугольный блок разъемной конструкции, внутри которого расположена круглая кассета для установки в нее флаконов с суспензионными пробами тест-организма. Кассета приводится во вращение электродвигателем, что обеспечивает равномерное перемешивание содержимого всех реакторов и снабжение культуры водоросли углекислым газом, содержащимся в окружающем воздухе. Одинаковое облучение всех проб водоросли осуществляется лампой накаливания мощностью 40 Вт, расположенной внутри корпуса культиватора, рядом с кассетой. Лампа является не только источником световой энергии для фотосинтеза водорослей, но и нагревательным элементом, обеспечивающим нагрев проб тест-культуры.
 .
.
Рис.2.4. Многокюветный культиватор водорослей (Фитотестор-03)
Для предотвращения перегрева реакторов в центре вращающей кассеты установлен вентилятор, который включается каждый раз, когда температура в корпусе прибора превышает установленный уровень. Последний задается термостатирующим устройством, также размещенным в культиваторе. После включения вентилятора происходит быстрое охлаждение внутреннего пространства культиватора более холодным внешним воздухом. При снижении температуры ниже требуемого вентилятор автоматически выключается. Таким образом, с помощью команд, подаваемых вентилятору, осуществляется процесс поддержания необходимой температуры в течение всего периода культивирования проб тест-организма [11].
Культивирование вирусов.
Вирусы – облигатные внутриклеточные паразиты. Они размножаются в живых клетках и не растут на искусственных питательных средах, поэтому методы культивирования вирусов отличаются от методов культивирования бактерий.
Методы культивирования.
1. На лабораторных животных. Заражают животных (подкожно, внутримышечно, внутрибрюшино), которые чувствительны к определенным вирусам: хорьков — вирусом гриппа, кроликов — вирусом бешенства, обезьян — вирусом полиомиелита. Индикация (обнаружение) вируса проводится по признакам заболевания. Недостаток метода — не все вирусы можно культивировать на животных, например, животные невосприимчивы к вирусам человека.
2. В куриных эмбрионах. Заражают куриный эмбрион (аллонтоисная полость, хорион-аллонтоисная оболочка, амниотическая полость, желточный мешок, сам эмбрион). Куриный эмбрион – очень удобен. Он защищен от попадания других микробов (стерильный), техника работы с ним проста, можно накопить большое количество вирусов. Индикация: а) по специфическим поражениям на хорион-аллантоисной оболочке, по гибели эмбриона, б) по реакции склеивания эритроцитов – реакции гемагглютинации (РГА). Недостатки метода: а)не все вирусы (вирус полиомиелита, вирус ящура) можно вырастить в куриных эмбрионах; б) невозможно обнаружить микроб без вскрытия эмбриона; в) в нем много загрязняющих белков и других соединений.
3. В тканевых культурах. Тканевые культуры или клеточные культуры – клетки, выращенные вне организма на искусственных питательных средах. Для их приготовления используют чаще всего эмбриональные и опухолевые ткани. Метод тканевых культур разработан Дж. Эндерсом в 50-е годы. Большинство вирусов способно размножаться в культурах клеток. Для каждого вируса можно подобрать наиболее чувствительную культуру клеток.
Бывают культуры растущих тканей и переживающих тканей (утративших способность к росту).
Существуют три типа растущих тканевых культур:
а) однослойные тканевые культуры – клетки прикрепляются и растут в виде сплошного монослоя по поверхности стекла лабораторной посуды;
б) культуры суспензированных клеток – клетки растут и размножаются во взвешенном состоянии;
в) органные культуры — кусочки органов животных и человека, выращиваемые вне организма.
Однослойные культуры – основные культуры. Различают: а) первичные – клетки этой культуры делятся один раз, поэтому каждый раз необходимо вновь получать культуру ткани; чаще всего используют эмбриональные ткани и опухолевые ткани взрослого человека;
б) полуперевиваемые – клетки делятся до 50 раз, сохраняя диплоидный набор хромосом; их можно перевивать несколько раз; используют диплоидные клетки человека (фибробласты человеческого эмбриона, диплоидные клетки легких человека);
в) перевиваемые – клетки культуры постоянно делятся в условиях in vitro (вне организма), поэтому их можно перевивать непрерывно; их готовят из линий клеток, которые хорошо размножаются в течение многих лет; чаще всего эти культуры получают из опухолевых клеток. Получено около 200 штаммов таких клеток: штамм L (из культуры мышиных фибробластов), штамм HeLa (из карциномы шейки матки), штамм Hep-3 (из лимфоидной карциномы) и т.д.
Первичные и перевиваемые линии клеточных культур могут быть загрязнены неизвестными вирусами, в том числе онкогенными, это ограничивает их применение, особенно в производстве вакцин.
Все работы с культурами клеток требуют строжайшего соблюдения правил асептики. К культуре клеток добавляют антибиотики против бактериального загрязнения.
Способы обнаружения (индикации) вирусов в тканевой культуре.
Вирусы можно обнаружить следующим образом.
1. По цитопатическому действию (ЦПД). В результате размножения вирусов в клетках происходят морфологические изменения клеток (вакуолизация цитоплазмы, деструкция митохондрий, округление клеток). Часть клеток погибает и отслаивается от стекла. Вместо сплошного монослоя остаются отдельные клеточные островки. ЦПД обнаруживают под микроскопом (8). По ЦПД можно не только обнаружить, но и идентифицировать вирусы. Например, вирус полиомиелита вызывает мелкозернистую деструкцию клеток; аденовирусы вызывают образование скоплений клеток в виде виноградных гроздьев; вирус кори вызывает образование симпластов – многоядерных клеток.
2. По образованию включений. Включения — скопления вирусов в клетках. Они имеют различную форму и размеры. Их окрашивают по Романовскому-Гимзе или флюорохромами и наблюдают под микроскопом.
3. По гемадсорбции. Клетки, зараженные вирусами, могут адсорбировать эритроциты. Вирусы выходят на поверхность клеток и связывают эритроциты. Эритроциты добавляют к культуре и через некоторое время промывают физиологическим раствором. На поверхности клеток под микроскопом видны прилипшие эритроциты в виде разнообразных фигур;.
4. По реакция гемагглютинации. Гемагглютинация — склеивание эритроцитов под влиянием вирусов. Эритроциты добавляют к культуральной жидкости. Если в ней есть вирусы, то эритроциты склеиваются.
5. По «цветной» реакции. Клетки культуры выращиваются на жидкой среде с индикатором (метиленовым красным). Индикатор изменяет цвет (с красного на желтый) под действием кислых продуктов метаболизма при росте нормальных клеток. Если клетки заражены вирусом, то нормальный метаболизм нарушается, кислые продукты не образуются и индикатор не изменяет цвет. Таким образом, признаком размножения вирусов в клетках культуры является сохранение красного цвета среды.
СПОСОБ КРУГЛОГОДИЧНОГО ПРОМЫШЛЕННОГО ВЫРАЩИВАНИЯ РЯСКИ ДЛЯ КОРМЛЕНИЯ СЕЛЬСКОХОЗЯЙСТВЕННЫХ ЖИВОТНЫХ
Изобретение относится к сельскому хозяйству, производству высокопитательных белково-витаминных минеральных кормов и добавок. В способе ряску выращивают в кюветах с использованием питательного раствора, естественного или искусственного освещения. Кюветы имеют длину 5-15 м, ширину 1-4 м и глубину 0,12-0,15 м и изготовлены из водонепроницаемого материала. Питательный водно-минеральный раствор содержит макроэлементы — азот, калий, кальций, магний и микроэлементы — железо, бор, цинк, медь, марганец, кобальт, йод. Количество высаживаемой ряски составляет 0,5 кг/м 2 поверхности питательного раствора. Ежедневно проводят сбор 50% от общей массы выращенной ряски из 1/7 от общего количества кювет. Вторую половину оставляют для дальнейшего воспроизводства. С апреля по октябрь выращивание осуществляют на площадках при естественной температуре и продолжительности светового дня. С октября по апрель ряску выращивают в помещении в искусственно создаваемых условиях с автоматическим регулированием уровня поверхности растворов и продолжительности светового дня. Способ позволяет промышленно производить высокопитательный белково-витаминный корм, который хорошо усваивается организмом животных.
Способ круглогодичного промышленного выращивания ряски для кормления животных, включающий ее выращивание в кюветах с использованием питательного раствора, естественного или искусственного освещения, отличающийся тем, что ряску выращивают в кюветах из водонепроницаемого материала длиной 5-15 м, шириной 1-4 м и глубиной 0,12-0,15 м на питательном водно-минеральном растворе, который содержит макроэлементы — азот, калий, кальций, магний и микроэлементы — железо, бор, цинк, медь, марганец, кобальт, йод, количество высаживаемой ряски составляет 0,5 кг/м 2 поверхности питательного раствора, ежедневно проводят сбор 50% от общей массы выращенной ряски из 1/7 от общего количества кювет, вторую половину оставляют для дальнейшего воспроизводства, выращивание с апреля по октябрь осуществляют на площадках при естественной температуре и продолжительности светового дня, а с октября по апрель в помещении при искусственно создаваемых условиях с автоматическим регулированием уровня поверхности растворов и продолжительности светового дня.
Изобретение относится к сельскому хозяйству, в частности к производству высокопитательных белково-витаминно-минеральных кормов и добавок для питания животных и человека.
Известны способы производства одноклеточных водорослей: хлореллы, сценедесмуса, спирулины, в водно-минеральных растворах, содержащих макро- и микроэлементы при искусственном освещении. Недостатком предлагаемых способов является то, что использование получаемой жидкой суспензии указанных водорослей в кормлении животных ограниченно и затруднено, а сбор и высушивание являются трудоемкими процессами, в экономическом и хозяйственном отношении их производство невыгодно. Кроме того, инертная и плотная оболочка клеток указанных водорослей препятствует усвоению питательных веществ организмом животных.
Цель изобретения — провести поиск водных растений, которые быстро бы размножались, их можно было бы легко собирать, отделять от водно-минеральных растворов, разработать способы их выращивания круглогодично на искусственных водно-минеральных питательных средах, обеспечивающих ежедневное производство высокопитательного белково-витаминного корма, питательные вещества которого хорошо усваивались бы организмом животных.
Из водных растений наиболее пригодным было признано водоплавающее растение — ряска малая (Lemna minor), многолетнее растение семейства рясковых, (возможны и другие виды ряски). Ряска быстро размножается вегетативно в летнее время в пресных водоемах со стоячей водой, покрывая их поверхность сплошным зеленым ковром, за 6 суток удваивает массу. По химическому составу ряска незначительно отличается от химического состава вышеуказанных одноклеточных водорослей, при скармливании животным (свиньям, сельскохозяйственной птице) стимулирует продуктивность, воспроизводительные способности, повышает иммунитет.
Способ выращивания заключается в следующем. В весенне-летний сезон на площадке устанавливают кюветы, изготовленные из водонепроницаемого материала (но не железные). Размер кювет может быть разный: длина от 5 до 15, ширина — от 1 до 4, глубина — 0,12-0,15 м. Количество кювет или рядов кювет должно быть кратным 7.
В кюветы заливают питательный раствор, содержащий макро- (азот, кальций, калий, магний) и микроэлементы (железо, бор, цинк, медь, марганец, кобальт, йод). Количество раствора должно быть таким, чтобы поверхность его была на 1-2 см ниже верхней стороны кювета. На питательный раствор высаживают ряску в количестве 0,5 кг на 1 м 2 . В связи с испарением воды постоянный уровень питательного раствора поддерживается автоматически с помощью поплавковых регуляторов или вручную способом долива раствора из лейки один раз в два-три дня.
Для обеспечения ежедневного, равномерного, беспрерывного производства ряски осуществляют ее конвейерный сбор. В первый день недели половину ряски снимают с первой кюветы (первого ряда кювет) и используют по назначению, а вторую половину оставляют для дальнейшего воспроизводства, распределив ее равномерно по поверхности питательного раствора. На второй день недели сбор производят из второй кюветы (второго ряда кювет) и т.д. Когда ряска будет собрана из седьмой кюветы (седьмого ряда кювет), в первой (первом ряду) она удвоит массу, и процесс сбора повторяют в той же последовательности, начиная с первой кюветы (первого ряда). Это дает возможность обеспечивать ежедневно производство равномерного количества ряски, проводить ее выращивание круглогодично: с апреля-мая по сентябрь-октябрь при естественных температуре и продолжительности светового дня, а с октября по апрель — в помещении при искусственно создаваемом температурном и световом режиме. Установлена также возможность выращивания ряски без смены посадочного материала в помещении при искусственно создаваемом тепловом и световом режиме.
При выращивании в помещении кюветы размещают на стеллажах в несколько ярусов. Размеры кювет такие же, как и при выращивании ряски в весеннее-летний сезон на площадках. При таком размещении кювет каждый ярус оборудуют электролампами накаливания или дневного света, обеспечивающих требуемое освещение и длину светового дня 17-18 часов, которая регулируется прибором с часовым механизмом автоматически.
Сбор ряски проводят вилоподобными или лопатоподобными устройствами с сетчатым наконечником. Ряска вынимается их кювета и затаривается в выварки или другие сосуды с крышками и перфорированными вкладышами, которые вставляют так, чтобы они располагались на расстоянии примерно 10 см от дна. При сборе ряски основная масса раствора остается в том же кювете, остаточная масса сбегает с ряски при отстаивании через перфорированный вкладыш на дно сосуда.
После отстаивания ряску или сразу же используют для кормовых или воспроизводительных целей, или ее можно хранить в сосудах с закрывающейся крышкой при температуре от 4 до 10°С без порчи сроком до одного месяца. При избыточном получении ряску, не употребленную в свежем виде, консервируют способом высушивания до воздушно-сухого состояния при той же температуре, при которой производилось выращивание. Для этого ее расстилают в тени тонким слоем (до 5 см) на полиэтиленовой пленке или брезенте. Для ускорения высыхания 1-2 раза в сутки перемешивают.
1. Семейство рясковые (Lemnaceae). / Жизнь растений, т.6. — М.: Просвещение, 1982-542 с.
2. Нетрадиционные корма в рационах сельскохозяйственных животных. — М.: Колос, 1984-272 с.
3. Лакомство для птицы. // Птицеводство — 2001 — №4 — с.61.
На искусственных питательных средах можно выращивать

Во времена СССР территория фабрики относилось к Кременчугскому совхозу. Там были и теплицы, и успешное производство. Но со временем все пришло в упадок. В начале 2000-х предприятие понемногу начали отстраивать. Предыдущие владельцы выращивали цветы, в основном — розы. Со временем конъюнктура рынка изменилась и бизнес закрыли.
В 2008 г., в разгар кризиса, овощная фабрика начала работать и стала первым и единственным производством, которое применило технологию проточной гидропоники. В тот год почти 70% тепличных хозяйств Украины стали убыточными, что во многом было связано с ростом себестоимости производства продукции (в т.ч. из-за роста цен на газ) и уменьшением рентабельности бизнеса. После кризисного периода началось постепенное технологическое переоснащение производства. Его сделали более энергоэффективным, соответственно, увеличилась рентабельность.
Уже в конце 2009 г. были смонтированы производственные линии, а на полную мощность предприятие заработало в 2010-м. Так и появилась «Кременчугская овощная фабрика» в ее нынешнем виде.
Начинали тепличное производство с огурцов и помидоров, потом добавили зелень (рукколу, салат, базилик), которую сейчас по всей Украине реализуют через торговую сеть Fozzy Group под маркой «Зелена країна». Свою торговую марку не запускают специально, ведь так проще для самой фабрики — продукцию поставляют реализаторам, а дальше ее уже продают с ТМ или без нее. Сейчас в обработке у КОФ 4 га земли — 3,5 га отведено под овощи (помидоры, огурцы) и 0,5 га под зелень (базилик, рукколу, салат, рассаду).
Интересно то, что Сергей Шевченко, который сейчас эффективно управляет производственным процессом на «Кременчугской овощной фабрике», ранее учился в ХАИ и по образованию он — инженер-механик авиадвигателей. Но жизнь — непредсказуемая штука, и теперь он стал успешным аграрием.
Фабрика выращивает зелень на проточной гидропонике. То есть корневая система растения развивается не в привычной для нас почве, а во влажно-воздушной, твердой, но пористой среде, которая способствует дыханию корней. В качестве субстрата используется гравий, щебень, керамзит, вермикулит, кокосовые маты. Поливают растения специальным раствором, приготовленным строго под выращиваемую культуру. Выполняется полив часто, несколько раз в сутки, или даже постоянно (капельным методом).
В работе на КОФ есть дополнительное преимущество — ее работники ходят загорелыми круглый год благодаря лампам досвечивания в теплицах. Всего на предприятии работает около 100 человек. Производство обеспечивает работой людей из близлежащих 5-6 сел и города Кременчуг. Фабрика бесплатно возит своих сотрудников на работу и обратно. Средняя заработная плата здесь выше, чем в областном центре, так как иначе хорошие кадры не сохранишь.
Все семеноводческие компании периодически проводят семинары за границей для популяризации своего продукта. Поэтому работники КОФ регулярно посещают такие мероприятия, чтобы набраться полезного опыта. Мировым образцом тепличных производителей является, конечно же, Голландия. Именно туда чаще всего и ездят на обучение кременчугские тепличники. Специалисты из голландских и финских компаний также активно приезжают поделиться знаниями в Украину.
В Украине цены на тепличные овощи и зелень постоянно колеблются. В этом году, к примеру, они были ниже, чем в 2016-м. Рынок сбыта существенно уменьшился за счет того, что две густонаселенные индустриальные области — Донецкая и Луганская — оказались отрезанными от Украины. Ситуация получается довольно сложная: пропал потребитель и уголь также остался «на той стороне». Из-за этого многие теплицы, например в Днепропетровской области, стоят даже не накрытыми. Поскольку и производство недешевое, и с топливом проблемы.
Сергей Александрович рассказал, что выход из таких непростых ситуаций тоже есть. К примеру, снизить себестоимость продукции можно двумя способами: первый — повысить урожайность, а второй — автоматизировать рабочий процесс. То есть одну и ту же работу будет выполнять меньшее количество людей, но уже с более высокой заработной платой.
А вот для повышения урожайности нужно инвестировать в новое тепличное оборудование. К примеру, построить «умные» теплицы, в которых климатом полностью управляет компьютер: вентилирует, отапливает, поливает и т.д. Но программирует его человек. Голландцы много экспериментируют в этой сфере. Существуют полностью «герметичные» хозяйства, которые ничего не берут извне и работают без отходов производства. Но это довольно сложные системы, которые пока действуют в виде концепта.
Кременчугские тепличники присматриваются и к внедрению светодиодного досвечивания. На овощной фабрике при выращивании огурцов и зелени зимой растения досвечивают мощными натриевыми лампами. Электроэнергия для предприятий каждый месяц дорожает — на 0,5-2 коп. А использование светодиодного освещения позволит потреблять в разы меньше, но иметь тот же уровень досвечивания, имеющийся сегодня. Эта технология дорогая, но со временем она себя окупает. Ведь даже в быту LED-светильники вытесняют лампы накаливания.
Устройство для выращивания растений на искусственных питательных средах
Патент 262541

Устройство для выращивания растений на искусственных питательных средах



К АВТОРСИОМУ СВИДЕТЕЛЬСТВУ
Зависимое от авт. свидетельства №
Заявлено 26.II.1966 (> 1058481/30-15) с присоединением заявки №
Опубликовано 26.I.1970. Бюллетень ¹ 6
Дата опубликования описания 21 V.1970
Комитет по делам изобретений и открытий при Совете 1.1иииотрое
УДК 631 589.2(088.8) !!
H Л. Воробьева, Н. Д. Келлер, Д. А. Лакиза, Ю, Н, Липов, В. А. Терпигорев, P. И. Штрейс, А, Д. Лакиза и Л. А.; Ивтодий,, Всесоюзный научно-исследовательский институт сельскохозяйственного машиностроения и совхоз «Тепличный»
УСТРОЙСТВО ДЛЯ ВЫРАЩИВАНИЯ РАСТЕНИЙ HA
ИСКУССТВЕННЫХ HHTATEJlbHblX СРЕДАХ
Из вестны различные устройства теплиц для выращивания растений на гравийных субстратах, при которых питательный раствор периодически подаегся в гравий по субирригационному методу.
В односекционных системах раствор подается одновременно на всю площадь, занятую культурой. Экономические сообр ажения огр аничивают область применения односекционных систем, Например, для орошения площади гравия 800 лгз с толщиной слоя субстрата
20 см при современных конструкциях стеллажей необходимо иметь запас раствора не менее 80,и .
Анализ стоимости строительства гидропони кумов показывает, что затраты на сооружение резервуара и водонепроницаемых беToHHbIx вместилии субстрата составляют соответственно 3 и 30 /О от общей стоимости строительства теплицы.
Был предложен способ секционирования, при котором площадь, занимаемую под культуру, разбивают на изолированные друг от друга равные участки-секции, и раствор подают поочередно в каждую секцию. Этот способ позволил уменьшить габариты резервуара н объем циркулирующего раствора пропорционально числу секций. Однако способ секционировапия по сравнению с односекционной системой имеет также ряд недостатков: питание растений в разных секциях происходит со значительной разницей во времени, усложнилось устройство ирригационной системы, появился новый сложный механический узел — распределитель раствора со специальным дриводом, уход и эксплуатация оборудования также усложнились, так как для управления распределением раствора необходима разветвленная релейная электросхема.
10 Секции гидропонных теплиц в известных устрой ствах выполняются либо в;виде GIIJIQIIIных корыт-бассейнов, либо в виде стеллажей шириной от 30 см и больше, соединяемых по торцам в единую секцию трубопроводом с
15 вводными патрубками.
Недостатком стеллажной секции является трудность достижения одновременности и равномерности .наполнения и слива всех стеллажей питательным раствором. Для регули20 рования равномерности применяют вентили на вводных патрубках. Применение вентилей с вводными чатрубками и уравнительных труб не дает необходимой равномерности, так как место соединения трубы со стеллажом созда25 ет большие гидравлические потери. Усиление же напора в трубах для достижения необходимого уровня раствора в конце стеллажа приводит к превышению уровня раствора в начале стеллажа, что нежелательно по агро30 техническим требованиям. Поэтому известные
60 в гидропонике технические решения не,позволяют изменить пьезометриечский уклон фильтрующегося через корнеобитаемую среду питательного раствора.
Другой существенный недостаток известных систем, как стеллажных, так и со оплошными бассейнами, состоит в том, что расход материалов для строительства стеллажей, расход питательного раствора и субстрата в .несколько раз превышают количество, .необходимое для обеспечения потребности корневой системы.
Потреоности корневой системы в ми неральном питании, в частности, в гидропонных системах, можно удовлетворить при очень небольших объемах корнеобитаемой среды (100 — 150 см ). Однако в производсввенных условиях приемлемо лишь такое устройство
— вегетационных участков, которое обеспечило бы циркуляцию питательного расввора через субстрат в пределах: 15 20 мин — наполнение и 20 — 15 мин — слив. При этом приходится идти на увеличение .минимально необходимого объема ко рнеоб итаемой среды на одно растение до б000 см .
Предлагаемое устройство отличается тем, что, с целью упрощения системы подачи раствора, снижения строительных и эксплуатационных затрат лри выращивании растений основной культуры с раз ветвленной вегетативной частью блок вегетационных стеллажей, равномерно размещенных по площади теплицы, имеет суммарную площадь поверхности субстрата не более 20 /о от ин вентарной.
На чертеже приведена схема предлагаемого устройства.
Оно представляет собой блок стеллажей в виде